Defenisi Enzim
Asal kata : bahasa Yunani, en = dalam dan zyme =
bahan adonan roti, yang berarti in yeast
: sesuatu yang terdapat di dalam sel/ragi
1) katalis
dalam proses biokimia, baik di luar maupun di dalam sel.
2) protein
yang mengkatalisis reaksi kimia spesifik.
3) menurut Dixon dan Webb : protein yang
bersifat katalis àdisebabkan
kemampuannya mengaktifkan senyawa lain secara spesifik
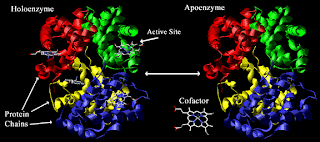
Bagian-bagian
enzim
1) Apoenzim; protein
enzim
2) Holoenzim; enzim
keseluruhan yang bersifat katalitik
3) Kofaktor; gugus
selain protein
Kofaktor/koenzim dapat dipandang sebagai kosubstrat. Alasan yang mendasari :
Kofaktor/koenzim dapat dipandang sebagai kosubstrat. Alasan yang mendasari :
a)
Apa yang
terjadi pada koenzim tepat kebalikan dari apa yang terjadi pada substrat
b)
Apa yang
terjadi pada koenzim lebih merupakan tujuan reaksi daripada apa yang dialami
oleh substrat.
4) Koenzim
kofaktor
yang dapat dipisahkan dengan cara dialisis biasa Umumnya
vitamin adalah koenzim (bentuk langsung atau derivate/turunan)
5) Gugus
prostetik
kofaktor/koenzim yang terikat kuat pada bagian protein enzim
(sulit terurai dalam larutan)
6) Aktivator
molekul
kimia kecil, dapat berupa atom logam/unsur atau senyawa dengan BM kecil yang
terikat dengan kuat ataupun longgar dengan bagian apoenzim.
Peran logam
pada suatu enzim seringkali sangat menentukan aktivitas enzimatik.
Koenzim
|
Senyawa yang dipindahkan
|
Tiamin pirofosfat
Flavin adenine dinukleotida
Nikotinamida adenine dinukleotida
Koenzim A
Piridoksal fosfat
5′-deoksiadenosilkobalamin (koenzim B12)
Biositin
Tetrahidrofolat
|
Aldehida
Atom hydrogen
Ion hidrida (H-)
Gugus asil
Gugus amino
Atom H dan gugus alkil
CO2
Gugus satu karbon lainnya
|
Unsur anorganik
|
Jenis enzim
|
Fe2+ atau Fe3+
Cu2+
Zn2+
Mg2+
Mn2+
K+
Ni2+
Mo
Se
|
Sitokrom oksidase
Katalase
Peroksidase
Sitokrom oksidase
DNA Polymerase
Karbonik anhidrase
Alcohol dehidrogenase
Heksokinase
6-fosfatase glukosa
Arginase
Piruvat kinase (jg perlu Mg2+)
Urease
Nitrat reduktase
Glutation peroksidase
|
7) Proenzim (zymogen)
enzim
inaktif. Umumnya diproduksi di tempat berbeda dari tempat dimana ia dibutuhkan.
Contoh : pepsinogen(sel-sel utama epitel mukosa lambung). Oleh HCl (sel-sel
parietal epitel lambung) dihidrolisis menjadi pepsin dan peptide kecil di
lambung.Jika pepsin telah terbentuk di epitel lambung maka bisa terjadi
kerusakan epitel mukosa itu sendiri.
Penamaan
:diberi awalan pro atau diberi akhiran ogen.
Cth :
protrombin dan tripsinogen.
Klasifikasi
dan tata nama enzim
1) Berdasarkan
substrat
Contoh : laktase,
maltase, proteinase.
Kelemahan
:banyak enzim yang berlainan bekerja pada satu substrat dengan cara berbeda
namun menghasilkan produk yang sama.
Contoh :
Glukosa + O2à glukonolakton + H2O2
(enzim yang bekerja dinamakan glukase)
Glukosa +
NADP+à
glukonolakton + NADPH + H+ (enzim yang bekerja dinamakan glukase)
2) Berdasarkan
jenis ikatan kimia substrat
Contoh :
peptidase, fosfatase, esterase.
Ada
kerancuan seperti pada fosfatase yang sebenarnya juga merupakan esterase
(memecah ikatan ester)
Peptidase
sendiri dapat dibagi menjadi beberapa jenis lagi yang mempunyai kekhususan
tersendiri seperti karboksipeptidase, aminopeptidase, dipeptidase.
Tata nama
ini tidakmenjelaskan apakah ikatan kimia yang mendasari penamaan tsb dipecah
atau dibentuk oleh enzim yang bersangkutan.
3) Berdasarkan
jenis reaksi
Contoh ;
glukosa oksidase, amino transferase/transaminase.
Jika
berdasarkan asas ini maka enzim-enzim yang melakukan hidrolisis seperti
esterase, glikosidase seharusnya dinamakan hidrolase.
4) Hubungan
tata nama dan klasifikasi
Klasifikasi
yang tepat dan deskriptif haruslah didasarkan pada suatu tata nama yang tepat.
Hal tsb terlihat dari usaha klasifikasi sebelumnya (bagian 1-3) dimana ada
cukup banyak enzim yang tidak tertampung dalam system tsb.
Klasifikasi
yang dilakukan oleh Baldwin (berdasarkan jenis reaksi, terbagi dalam 4 kelas)
belum menghasilkan tata nama yang deskriptif dan informative.
Demikian
pula yang dilakukan oleh Webb dan Dixon (berdasarkan jenis reaksi yang
dikatalisis, terbagi dalam 3 kelas) tidak lebih memuaskan dibandingkan dengan
klasifikasi oleh Baldwin.
5) Berdasarkan
IUB
Dasar
klasifikasi : jenis reaksi. Terbagi atas 6 kelas yang dibagi lagi menjadi 4-20
subkelas.
Berdasarkan IUB
Dasar klasifikasi : jenis reaksi. Terbagi atas 6 kelas
yang dibagi lagi menjadi 4-20 subkelas.
I. Oksidoreduktase
Adalah enzim
yang mengkatalisis pemindahan hydrogen dari suatu substrat ke substrat
lainnya.Terbagi atas golongan dehidrogenase dan oksidase.Secara umum golongan
ini terbagi atas 20 subkelas.
Contohnya :
Alcohol dehidrogenase (reaksi
pembentukan aldehid dari alcohol)
glukosa oksidase (katalis pada
reaksi oksidasi glukosa à
asam glukonat)
II. Transferase
Adalah enzim yang bekerja sebagai
katalis pada reaksi pemindahan suatu gugus dari suatu senyawa ke senyawa
lainnya.Contohnya :
Metiltransferase, aminotransferase
/ transaminase
III.
Hidrolase
Adalah enzim
yang bekerja sebagai katalis pada reaksi hidrolisis. Terbagi atas 11 sub kelas.
Contohnya esterase, lipase, fosfatase.
IV.
Liase
Adalah enzim yang berperan dalam
reaksi pemisahan suatu gugus dari suatu substrat atau sebaliknya dengan cara
selain hidrolisis. Terbagi atas 7 sub kelas. Contohnya dekarboksilase,
aldolase, hidratase.
V. Isomerase
Adalah enzim yang bekerja pada
perubahan intramolekuler, yaitu reaksi isomerisasi.Contohnya adalah
glukosafosfat isomerase, ribulosafosfat epimerase.
VI.
Ligase
Adalah enzim yang bekerja pada reaksi
penggabungan dua molekul.Dinamakan juga sintetase.Ikatan yang terbentuk dari
penggabungan ini adalah ikatan C-O, C-S, C-N, C-C, disertai penguraian ikatan
berenergi tinggi seperti ATP.Contohnya :piruvat karboksilase, glutamine
sintetase.
Tata nama menurut IUB
Tiap enzim ditetapkan ke dalam empat tingkat nomor
kelas dan diberikan suatu nama sistematik yang mengidentifikasikan reaksi yang
dikatalisis.
Contoh :
EC. W.X.Y.Z, dimana
EC à
penamaan menurut Enzyme Commission Number System
W à
kelas reaksi yang dikatalisis (gol. I – VI)
X
àsubkelas,
yaitu substrat atau gugus yang bereaksi
Y
àsub-subkelas,
yaitu substrat spesifik atau koenzim yang terlibat
Z ànomor
seri enzim
EC. 2.7.1.2 ATP:D-glukosa
6-fosfotransferase.
Enzim ini adalah enzim kelas II
(Transferase) subkelas 7 (memindahkan gugus mengandung fosfor), sub-subkelas 1
(fosfotransferase dengan gugus alkohol
sebagai penerima).
Reaksi yang dikatalisis adalah :
D-glukosa + ATP
Glukosa 6-fosfat + ADP
No. klasifikasi enzim : EC.1.1.1.1
Nama sistematik enzim : Alkohol:NAD+oksidoreduktase
Nama generik enzim : Alkohol dehidrogenase
Model
enzim :
1) Model Kunci dan Anak Kunci (Lock and Key) oleh
Fischer
Ketika
substrat bertemu dengan enzim dalam perbenturan keduanya mungkin terjadi
perbenturan pada bagian tertentu dari molekul enzim yang strukturnya sedemikian
rupa sehingga dapat diduduki secara pas oleh substrat dan terbentuk kompleks
ES.
E S ES E P
Model ini
mampu menerangkan proses katalisis dengan satu substrat ataupun sejumlah
substrat yang terjadi berurutan. Model ini cocok untuk menerangkan analisis
kinetika sederhana seperti yang diajukan oleh Michaelis-Menten; menerangkan
ikatan enzim dengan penghambat bersaing dengan adanya bagian aktif (active
site) yang spesifik à juga
menerangkan hanya sebagian kecil dari bagian molekul enzim yang berperan dalam
prose katalitik enzim.
Kekurangan :
-
Bentuk enzim dan substrat yang digambarkan adalah tegar/kaku/tidak
lentur. Ada atau tidak ada substrat di sekitarnya struktur 3D molekul tidak
berubah dan situs aktif tetap terbuka dalam keadaan siaga, hal ini dengan
sendirinya mempunyai tingkat energy tertentu yang terus-menerus harus
dipertahankan (darimana energy ini berasal jika enzim tsb telah dimurnikan dan
dikeringkan dalam waktu cukup lama? Bila
energy termodinamik berasal dari lingkungan akibat adanya gerak acak Brownsusah
utk diterima karena pada nilai tertentu energy termodinamik malah berpotensi
merusak molekul enzim). Selain itu karena merupakan hasil benturan yang
merupakan peristiwa acak dan hanya bagian kecil molekul enzim yang berperan
dalam maka peluang tiap benturan tidak sama (kecil).
-
tidak memberikan gagasan bagaimana proses katalisis terjadi. Enzim
tidak dapat membedakan mana substrat dan bukan substrat. Tidak ada penjelasan
apa yang terjadi setelah terbentuk kompleks dimana mengapa kompleks ES diolah
sedangkan kompleks EI tidak (tidak dapat membedakan tahap pengikatan dan tahap
pengolahan).
-
tidak mampu menjelaskan fenomena penghambatan tak bersaing dimana
kompleks ES tetap terbentuk namun kompleks yang dihasilkan tidak menghasilkan
apa-apa.
2) Model Suai-Bentur (Induced Fit) oleh Koschland
Berdasarkan
analisis spectrum dan gambaran kristalografi sinar X dari kompleks ES diketahui
bahwa dalam antaraksi enzim-substrat, untuk dapat mengikat dan mengolah
substrat tidak hanya bagaian molekul enzim yang berkontak dengan substrat, akan
tetapi seluruh bagian molekul enzim aktif menyesuaikan diri mengambil bentuk
sedemikian rupa sehingga ada bagian yang dapat mengikat dan mengolah
substrat (terjadi perubahan konformasi
3D).
E S E ES E P
istilah
bagian aktif menjadi kurang tepat karena semua bagian molekul enzim berperan
aktif dalam menyusun diri sedemikian rupa sehingga substrat dapat diikat dan
diperkenalkan istilah bagian katalitik (catalytic site).
Model ini
dapat mengatasi beberapa fenomena yang tidak dapat dijelaskan oleh model
Fischer namun masih belum dapat menjelaskan secara khusus fenomena penghambatan
tak bersaing (non kompetitif).
3)
Model Ketuk
Tular (Pengaturan Alosterik) oleh Monod-Wyman-Changeux
Adanya tempat lain yang dikenal dengan nama
bagian alosterik (bahasa Yunani, allos : yang lain; stereos : ruang) selain
bagian katalitik. Perubahan konformasi subunit yang mengandung bagian/tempat
alosterik menjalar ke subunit yang mengandung tempat/bagian katalitik
sedemikian rupa sehingga bagian katalitik dapat mengikat substrat tetapi tidak
dapat mengolahnya lebih lanjut untuk menghasilkan produk.
Koenzim
|
Senyawa yang dipindahkan
|
Tiamin pirofosfat
Flavin adenine dinukleotida
Nikotinamida adenine dinukleotida
Koenzim A
Piridoksal fosfat
5′-deoksiadenosilkobalamin (koenzim B12)
Biositin
Tetrahidrofolat
|
Aldehida
Atom hydrogen
Ion hidrida (H-)
Gugus asil
Gugus amino
Atom H dan gugus alkil
CO2
Gugus satu karbon lainnya
|
Sifat dan Kerja Enzim
Spesifitas kerja enzim
-
Spesifitas stereoisomer
-
Spesifitas ikatan kimia
-
Spesifitas gugus
-
Tingkat spesifitas
Contoh enzim dengan spesifitas yang rendah
adalah enzim-enzim pencernaan.
Contoh enzim dengan spesifitas yang tinggi
adalah enzim-enzim yang diperlukan dalam metabolism antara (intermediate
metabolism)
Mekanisme katalisis (Daya
Katalitik)
Faktor-faktor yang mendukung efisiensi katalisis enzim
:
1) Letak dan orientasi substrat dalam
hubungannya dengan gugus katalitik
Ukuran enzim yang sangat besar memberi
peluang yang sangat besar bagi benturan antar molekulàmemulai
perubahan konformasi membentuk struktur 3D peralihanà substrat
berjumpa bagian katalitik enzimakan mudah berikatan dengan tepat. Dengan demikian
terjadi pendekatan gugus-gugus aktif dari enzim dan substratà
kemampuan pengarahan orbital (orbital steering) shg merupakan reaksi yang
benar-benar terarah (bukan acak).
2) Stabilisasi stadium transisi,
yaitu dorongan perubahan yang tepat.
Jika telah terjadi pengiblatan yang
tepat dari electron orbit gugus-gugus reaktif, maka substrat diregang sehingga
struktur transisi dicapai untuk selanjutnya tercapai bentuk antara dan disusul
dengan transaksi proton sehingga terbentuk senyawa produk yang dilepaskan oleh
enzim.
3)
Katalisator
umum asam basa
4)
Katalisator
nukleofilik
5)
Katalisator
elektrofilik
6)
Katalisator
kovalen
Secara umum proses katalisis bukan enzim
dapat dikelompokkan dalam katalisis asam-basa, katalisis elektrostatik, dan
katalisis kovalen. Enzim memiliki
semua/sebagian dari mekanisme katalisis tsb dalam molekulnya sedangkan bagian
protein memberikan
suasana yang mendukung untuk terjadinya proses katalisis tsb.
Faktor-faktor yang
mempengaruhi kerja enzim
-
Konsentrasi
substrat
Mengikuti persamaan Michaelis-Menten,
dimana pada saat konsentrasi substrat
rendah maka laju reaksi mengikuti reaksi orde satudimana kenaikan konsentrasi substrat akan meningkatkan
laju reaksi sedangkan pada saat konsentrasi
substratmeningkatjauh melampaui harga K, maka peningkatan konsentrasi
substrat tidak akan mempengaruhi laju reaksi (laju reaksi berada pada orde nol).
-
Konsentrasi
enzim
Laju reaksi berbanding lurus dengan
konsentrasi enzim à makin tinggi
konsentrasi enzim makin besar laju
reaksinya.
-
pH
karena merupakan suatu protein maka enzim
mempunyai aktivitas maksimum pada pH tertentu yang dikenal dengan nama pH
optimum. Di luar nilai pH optimum maka
aktivitas enzim akan berkurang bahkan dapat kehilangan aktivitasnya. Hal ini
disebabkan karena terjadi denaturasi.
-
Suhu
Makin besar
perbedaan suhu reaksi dengan suhu optimum, makin rendah laju reaksi.Pada suhu lebih rendah penyebab kurangnya laju
reaksi enzimatik adalah kurangnya gerak termodinamik.Sedangkan pada suhu lebih
tinggi selain gerak termodinamik meningkat juga terjadi denaturasi sehingga
bentuk 3D berubah secara bertahap.
Penghambatan kerja enzim (inhibisi enzim)
Inhibitor atau penghambat kerja enzim adalah senyawa
yang menurunkan kecepatan reaksi enzimatik.
Terdapat 2 jenis penghambat utama enzim, yaitu :
1) Penghambatan tidak dapat balik
(irreversible), yaitu penghambat yang bekerja dengan cara bereaksi
dengan atau merusakkan suatu gugus fungsional pada molekul enzim yang penting
bagi aktivitas katalitiknya.
Contohnya : diisopropilfluorofosfat
(DFP) menghambat enzim asetilkolenesterase àtransmisi impuls
saraf terganggu.
Catatan
: tidak semua penghambatan bersifat merusak. Misalnya manfaat
lain dari DFP yaitu menginaktivasi malathion (insektisida) à
dapat diuraikan hewan tingkat tinggi àproduk yang
tidak berbahaya bagi manusia dan hewan tsb, namun pada serangga kerja enzim tsb
hanya menghambat asetilkolinesterase tanpa dapat mengubah metabolitnya menjadi
produk yang tidak toksik bagi serangga tsb.
2) Penghambatan dapat balik (reversible),
terbagi atas :
-
Penghambat
kompetitif,
adalah penghambat yang bersaing dengan substrat untuk berikatan pada sisi aktif
enzim dan setelah terikat tidak dapat diubah oleh enzim tsb.
Ciri : dapat
diatasi dengan meningkatkan konsentrasi substrat.
Umumnya mempunyai struktur mirip dengan struktur 3D substrat normal.
Contoh : penghambatan kompetitif
dehidrogenase suksinat oleh anion malonat
- Penghambat
nonkompetitif, adalah penghambatan yang terjadi akibat penghambat
berikatan pada sisi enzim selain sisi tempat substrat berikatan dan
mengakibatkan perubahan konformasi
molekul sehingga mengakibatkan inaktifasi dapat balik sisi katalitik.
Pemanfaatan
enzim
1) Bidang industri
-
Industry makanan dan minuman
Penggunaan protease pankreas dan papain sebagai pengempuk daging.
-
Industry non pangan
Penggunaan enzim (protease, σ-kapa-amilase,
dll) dalam deterjen untuk mempercepat
pelepasan kotoran dari pakaian
2) Bidang kesehatan (kedokteran dan farmasi)
Enzim
sebagai target pengobatan
Contoh :
Kekurangan enzim pencernaan dalam tubuh
dapat diatasi dengan memberikan obat berupa enzim pencernaan yang diperoleh
dari tumbuhan/hewan untuk mengatasi kekurangan produksi enzim pada tubuh.
Pemanfaatan
enzim untuk diagnose klinik
Penggunaan
enzim sebagai petanda kerusakan jaringan
Secara teoritis
enzim intrasel tidak terlacak dalam cairan ekstraselàsel-sel
mati dan pecah à terdapat enzim intrasel dalam cairan ekstraselà jumlahnya
rendah dan mempunyai harga maksimum (ditentukan laju pergantian atau “turn over rate” yang berhubungan dengan
keadaan fisiologis tertentu)
Bila jumlah enzim di luar normal àterjadi sesuatu
pada jaringan.
Peningkatan kadar enzim didalam cairan ekstrasel dapat
pula terjadi karena :
-
sel memasuki suatu
tahap tertentu dalam daur seluler
-
terjadinya perbanyakan
atau proliferasi sel-sel khusus yang membuat enzim tertentu à
dasar penggunaan enzim dan protein bukan enzim sebagai petanda tumor (tumor
marker).
Penggunaan
enzim sebagai reagen
Enzim murni yang tersedia di pasaran dapat digunakan
sebagai reagen unutk penentuan secara akurat adanya suatu zat yang kadarnya
kecil dalam darah seperti glukosa, urea, asam urat, dan trigliserida.
Contohnya : kit
untuk mengetahui adanya gula dalam urine.
Penggunaan
enzim sebagai reagen pemberi label
Enzim dapat dipergunakan sebagai alat bantu diagnostic
dengan cara lain, yaitu pengukuran berdasarkan angka “turn over”nya / nilai
aktivitas enzim, yaitu jumlah mol substrat yang diubah menjadi produk tiap
menit (atau tiap detik) per mol enzim.
Angka ini bermanfaat dalam membandingkan enzim yang sama dari jaringan
yang berbeda dan dalam membandingkan isozim yang berlainan
Contoh penggunaannya untuk penentuan secara cepat
penyalahgunaan obat, seperti penentuan morfin dan shabu-shabu dalam urin.Warna
yang dihasilkan menunjukkan ada tidaknya morfin sedangkan intensitas warnanya
menunjukkan kadar morfin yang dihasilkan.
Contoh lain : kit uji dengan metode ELISA (Enzyme
Linked Immuno Sorbant Assay).
Enzim “immobilized”
Enzim dapat disambung-silangkan (cross-linked) secara
kimiawi terhadap permukaan lembam, atau dijepit antara permukaan-permukaan semipermeabel
lembam tanpa kehilangan daya katalitik.
Misalnya urease yang ditempelkan pada tabung dialysis
untuk menghilangkan urea dalam darah pasien gagal ginjal.
Contoh lainnya adalah :
pembuatan
enzim electrode untuk analisis elektrokimia kadar komponen penyusun darah
seperti glukosa dan kolesterol.
Pembuatan
kit immunoassay untuk penggunaan pola isozim dari enzim tertentu dengan
elektroforesis dan teknik imunokimia, pelacakan dan penentuan kuantitas isozim
untuk kepentingan diagnose diferensial.
Tabel Daftar Penentuan dengan enzim yang dikenal atau
yang diperkirakan bermanfaat dalam diagnose atau perawatan penyakit.
Enzim
|
Organ
atau penyakit yang ditinjau
|
Yang sering diuji
Fosfatase asam
Fosfatase alkalin
Amylase
Aminotransferase glutamate
Aminotransferase aspartat
Aminotransferase alanin
Dehidrogenase laktat
Kinase keratin
Yang kurang sering diuji
Seruloplasmin
Aldolase
Tripsin
Dehidrogenase glukosa 6-fosfat
Γ-glutamil transpeptidase
Transkarbamilase ornitin
Pseudokolinesterase
Pepsin
Heksosa 1-fosfat-uridil transferase
Reduktase glutation
Lipase lipoprotein
Elastase
Plasmin
|
Karsinoma prostat
Hati, penyakit tulang
Penyakit pancreas
Hati, penyakit jantung
Hati, penyakit jantung
Hati, penyakit jantung
Hati, jantung, sel darah merah
Jantung, otot, otak
Penyakit Wilson (hati)
Otot, jantung
Pancreas, usus
Sel darah merah (kerusakan genetic)
Penyakit hati
Penyakit hati
Hati (keracunan, insektisida)
Lambung
Galaktosemia (kerusakan genetic)
Anemia, sianosis
Hiperlipoproteinemia
Penyakit kolagen
Penyakit pembekuan darah
|
3)
Bidang pertanian
Pemanfaatan bakteri nitrifikasi untuk menangkap
nitrogen dari udara untuk digunakan dalam pertumbuhan tanaman.


















0 komentar:
Posting Komentar